美国创新制药公司Relay成为行业龙头,“幕后英雄”是超算安腾
长久以来,我国药物研发创新回报不及预期。我国医药市场规模大,但创新药占比较低,医药创新链、产业链、资金链、人才链尚未实现深度融合,企业研发成本高,回报周期长,药物研发一直陷于“双十定律”——研发费用10亿美元,研发周期10年。一段时间内,坊间都在开始讨论“中国要不要自己搞创新药”的问题,跟在别人后面搞“仿创”似乎性价比更高。但最近国家发改委给了一个明确的答案,国家没有放弃创新药,发布了《关于全链条支持创新药发展实施方案的征求意见稿》,旨在通过政策引导和支持,全面促进创新药全链条关键环节。
近些年,越来越多的的药企将希望寄托在AI制药上,希望可以大幅减少药物研发的时间和成本。根据智药局数据监测,仅在2024年2月,全球就共有10家AI制药相关企业完成了新一轮融资,披露总金额约32.71亿人民币。其中,有3家中国AI制药企业也获得了新一轮融资。
但AI制药仍面临短期内难以克服的挑战,其中关键的难题之一就是由于多数AI制药公司依赖于公开渠道的数据资源,例如医学文献、公开靶点数据库等,因此,他们很难获取高质量的数据,而这些数据决定了AI模型输出结果的准确性。为应对这一挑战,AI制药企业要么选择自建实验室并发展独立研发管线,要么与大型药企建立合作关系以共享部分核心数据,但无论是自建路线还是共享路线,都对AI制药企业的资金储备和技术能力提出了更大的挑战。
尽管如此也有特例存在,美国制药公司Relay Therapeutics就创新性的绕开了这个关键难题。

让Relay在全球制药界一战成名的故事是,作为一家初创公司,Relay仅用18 个月、不到 1 亿美金就确认了一款胆管癌治疗药物 RLY-4008 的结构,这样的研发效率一下打破了多年来“双十定律”的禁锢。目前,RLY-4008已获得美国FDA和EMA的CCA孤儿药指定。得益于RLY-4008以及RLY-2608、GDC-1971等管线的亮眼研发表现,Relay于2020年7月顺利登陆纳斯达克,据称也是全球第二家上市AI药物研发公司。
究竟为何困扰全球制药业多年的研发效率低的问题,能被一家初创公司迅速攻克?
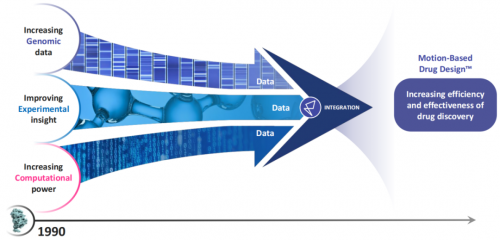
Relay的崛起还得归功于基因组、计算、实验三大领域应用科学的突破和创新。随着2003年人类基因组计划的完成,人们对遗传变异、蛋白质功能障碍和疾病病理学之间联系的理解不断进步,加上近些年计算能力和实验技术的更新迭代,为Relay这样一家以计算和实验相结合的研究方法为核心的新型AI制药公司的出现铺平了所有道路。
当然很显然的,当时也有许多其它的AI制药团队把握了这样的时代窗口机遇在进行创业,不过真正促成Relay成功的是因素是,它不仅是把握了天时地利,更重要的是在它的背后隐藏着一件“杀手锏”,支撑着它把计算+实验相结合的创新药物设计技术路径真正地在实践中跑通。
在医药研发领域,基于结构的药物设计(SBDD)是新药开发的关键技术路径之一。通过解析目标蛋白质的三维结构,研究人员能够精确地设计和优化药物分子,以提高其对特定生物靶标的亲和力和选择性,从而增加药物的功效和安全性。但完全基于蛋白质结构静态图像的SBDD方法限制了准确理解蛋白质在自然状态下的动态行为的能力,众所周知,蛋白质具有特定的氨基酸序列以及独特的分子结构,且不断运动,对于动态结构功能关系的理解的确实在很大程度上阻碍了药物的设计。
Relay则创新性的提出了基于运动的药物设计(Motion Based Drug Design(TM),MBDD)的技术路径。Relay通过MBDD的方式,将行业内对于蛋白质靶点的理解从过去的静态视图转变为基于蛋白质运动的动态视图,在突变蛋白中发现新的变构袋,对“难成药靶点”进行研发,从临床的角度进行差异化项目布局。
图片来源:Relay官方
但是,要看到动起来的蛋白质是很难的,目前唯一可行的研究方法是依赖高性能计算机进行模拟计算的分子动力学方法。但是,人体内典型的大分子蛋白质往往由几十万到上百万个原子构成,传统的分子动力学模拟方法计算一个100万原子的蛋白质运动0.001秒的“影片”,哪怕用上1000颗主流CPU并行计算,都需要耗费超过100年的时间。
为解决蛋白质分子动力学计算时间过长的问题,Relay开创性地构建了基于运动的药物设计平台——Dynamo Platform,集成了8种实验技术和8种计算方法,可以对蛋白运动进行检测和计算,从而进行创新药物设计。因此,Relay宣称自己将传统的SBDD升级为新一代的基于动力的药物设计MBDD。
而隐藏在Dynamo平台背后,真正帮助Relay突破长时间大尺度分子动力学模拟计算瓶颈、支撑它利用动态蛋白质结构发现突变蛋白质上结合口袋的“杀手锏”,其实是D.E. Shaw Research发明的安腾超级计算机(Anton)。
安腾超级计算机是一台特殊设计的、功能单一的专用超级计算机,被奉为美国的国宝级超算,以一己之力让美国在生物计算领域维持了十几年的统治地位。安腾超算采用了以ASIC芯片架构为核心的专用超算而非通用超算的技术发展路线,它被设计出来的目的只有一个:令分子动力学模拟运算得更快。而分子动力学模拟算法,就是前面提到的对生命科学研究和生物制药研发具有至关重要意义的研究算法,它也是目前唯一能够在微观层面揭示蛋白质动态运动特性的研究方法。与走在同样路线上只能采用传统计算资源(例如CPU/GPU/云计算等)的竞争对手相比相比,安腾超算赋予了Relay模拟更大体系规模、更长仿真时长的生物大分子运动的能力。

D.E. Shaw Research 安腾超级计算机 图片来源:网络
因此,在安腾超算的助力下,Relay在发展的过程中并不曾陷入过AI制药难以提升计算效率、或者缺乏高质量数据源的困局。专注解决分子动力学计算的超算安腾(Anton)采用了物理驱动的技术路线,基于物理定律来解释和预测生物系统的行为,就可以完全不依赖于先验的数据,还具备“天然准”的优势。安腾超算只需要知道蛋白质大分子的氨基酸序列,基于其初始三维结构状态和一系列环境参数的输入,就可以对蛋白质的结构变化和功能进行预测和研究,并且对于研究过程中的每一步都可以对数据进行分析和解释。
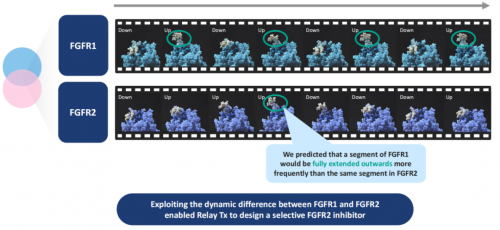
以上文提到的RLY-4008为例,RLY-4008是一种选择性成纤维细胞生长因子受体2(FGFR2)口服小分子抑制剂。FGFR2是一种在某些癌症中经常发生突变的受体酪氨酸激酶,是FGFR家族的四个成员之一,这组蛋白具有高度相似的蛋白质序列和特性。当前一些非选择性泛FGFR抑制剂已在携带FGFR2基因融合的肝内胆管癌(CCA)患者中证明了临床概念验证,但由于这些疗法同时对FGFR1和FGFR4具有抑制性,会不可避免地引起高磷酸血症和腹泻等副作用。
如果采用SBDD的研发方式,比较静态X射线晶体结构时,FGFR1和FGFR2之间存在高度的结构相似性,很难做出区别二者的选择性假设。通过安腾超算支撑的Dynamo研发平台的动态三维仿真能力,Relay通过长时间尺度的分子动力学模拟发现了FGFR1和FGFR2蛋白结构的动态差异:二者的蛋白结构上都存在一个规律地上下开合的片段,但该片段在FGFR1蛋白上开合的频率却明显高于FGFR2,这个发现使得Relay能够专门设计小分子药物,使其与FGFR1在该位置上结合后会脱落下来,但与FGFR2却可以在该位置紧密结合,从而实现对FGFR2的抑制。
图片来源:Relay官方
据Relay公开的人体临床试验初步数据显示,RLY-4008对FGFR2具有明显的抑制作用,并且不受到脱靶毒性的限制(如高磷酸血症)。2023年5月26号公布的最新数据显示,临床二期推荐剂量为70mg QD;在分组FGFRi-naïve CCA f/r中,客观缓解率(ORR)高达55%;在分组Prior-FGFRi CCA f/r中,ORR只有14%;说明接受过FGFRi治疗的患者中,ORR下降比较明显,在不同剂量下,最常见的TRAEs是低级别PPE(57%)、口炎(56%)、口干(38%)、脱发(28%)和眼干(22%)。
公开资料显示,传统研发路线从Hit(先导化合物发现)到Lead(先导化合物优化)一般需要3-5年时间,而由于安腾超算的助力,Relay可以缩短到18-24个月,即1年半到2年,并且筛选出的化学系列更多,这样可以覆盖更多IP领域。
中国科学院生命科学和医学学部院士、结构生物学家颜宁曾谈到,“希望AI下一步可以解决分子动力学模拟对于很多生物过程无能为力的问题”。从Relay的成功经历来看,正是凭借超级计算机安腾的强力支撑,Relay才能够实现创新的药物设计路线,基本验证了以分子动力学为特色的药物发现平台可以对创新药物的开发起到的巨大推动作用。因此,国内的创新药企业也可以换种解题思路,借力高性能计算结合实验的新研发范式,激发更多创新药物研发的可能性。
本文地址:http://www.cnzhilian.com/pinpai/2024-03-21/669963.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 上一篇:免门票!高速五折!贵州文旅诚邀全国医护工作者
- 下一篇:返回列表
- 美国创新制药公司Relay成为行业龙头,“幕后英雄”是超算安腾2024-03-21 09:46:56
- 免门票!高速五折!贵州文旅诚邀全国医护工作者2024-03-21 09:46:15
- 一起上春山!贵州国有A级景区对全国医护工作者免门票2024-03-21 09:44:10
- 皇家马洛卡俱乐部联袂星空体育,共铸亚洲体育新光辉2024-03-21 09:36:36
- 东融APP:急用钱,选择什么样的线上平台更放心?2024-03-21 09:26:09
-

 国家食品药品监督管理局查询入口
国家食品药品监督管理局查询入口
2023-05-11
-

 中国四大顶级医院
中国四大顶级医院
2023-09-13
-
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
2022-11-07 17:44:38
-
十大不建议买的纯牛奶排行,不能喝牛奶的原因
2023-06-30 14:06:52
-
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
2022-09-08 09:22:36
-
烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
-
张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
文章排行榜
- 周排名
- 月排名



