美国FDA批准诺华全球首创siRNA降血脂新药上市
近日,美国食品药品管理局(FDA)批准诺华的同类首创(first-in-class)小干扰RNA(siRNA)药物Leqvio(Inclisiran)上市,作为饮食和接受最高耐受剂量他汀治疗后的辅助治疗,用于需要进一步降低低密度脂蛋白胆固醇(LDL-C)的杂合子家族性高胆固醇血症(HeFH)或临床动脉粥样硬化性心血管疾病(ASCVD)成人患者。
Leqvio是FDA批准的首款也是唯一一款用于降低LDL-C的siRNA药物。
ASCVD是一个涵盖性术语,定义为动脉中斑块的积聚导致血流减少和一些其他严重情况,如心脏疾病(冠心病、心梗、急性冠脉综合征等)、脑部疾病(一过性脑缺血、缺血性脑卒中)、外周血管疾病等,其病理基础是动脉粥样硬化(AS)。高血脂尤其是LDL-C水平升高是导致ASCVD的主要危险因素之一,长期持续暴露于高水平的LDL-C会使ASCVD风险升高。
HeFH是一种罕见的危及生命的疾病,由于患者体内控制清除胆固醇的部分基因发生突变,导致患者的LDL-C水平通常比正常水平高2~3倍。而LDL-C水平升高会增加HeFH患者患心血管疾病的风险,如心脏病发作、中风和冠状动脉疾病等。
Leqvio的有效性是在3项随机、双盲、安慰剂对照临床试验中确认的。试验共纳入3457名接受最大耐受剂量他汀类药物治疗,但需要根据心血管事件风险进一步降低LDL-C水平的HeFH成年患者或ASCVD成年患者。在这3项研究中,主要的有效性结果衡量指标是从试验开始到第510天(第17个月)LDL-C的变化百分比。在每项试验中,患者分别在第1天、第90天(第3个月)、第270天(第9个月)和第450天(第15个月)皮下注射284mg Leqvi o或安慰剂。
试验1纳入了1561名ASCVD成年患者,第510天,Leqvio组患者的LDL-C平均下降51%,而安慰剂组患者的LDL-C平均增加1%。试验2纳入了1414名ASCVD成年患者,在510天,Leqvio组患者的LDL-C平均下降46%,而安慰剂组患者的LDL-C平均增加4%。试验3纳入了482名HeFH成年患者,第510天,Leqvio组患者的LDL-C平均下降了40%,而安慰剂组患者的LDL-C平均增加了8%。
Leqvio对心血管发病率和死亡率的影响尚未确定。
Leqvio常见的不良反应包括注射部位反应、关节僵硬、尿路感染、腹泻、支气管炎、四肢疼痛和呼吸困难等。 (来源:美国FDA网站;编译:付佳)
本文地址:http://www.cnzhilian.com/pinpai/2021-12-29/563542.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 上一篇:葵花药业拟引进两款儿童罕见病用药
- 下一篇:返回列表
- 美国FDA批准诺华全球首创siRNA降血脂新药上市2021-12-29 09:51:17
- 葵花药业拟引进两款儿童罕见病用药2021-12-29 09:51:04
- 广药集团建成澳门首个GMP标准中成药厂2021-12-29 09:50:49
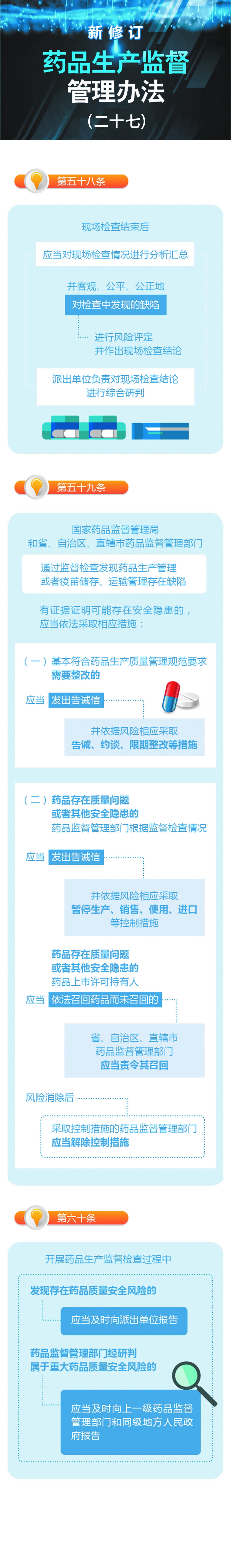
- 新修订药品生产监督管理办法(二十七)2021-12-29 09:50:24
- 经营不符合标准及未依法变更的医用防护服,如何定性处罚2021-12-29 09:50:05
-

 什么是阴痛?
什么是阴痛?
2021-10-26
-

 美立方国内外专家齐聚 颌面专家团再升级
美立方国内外专家齐聚 颌面专家团再升级
2021-08-23
-
《热点聚焦》医疗机构内新冠病毒感染防控有了新要求
2021-09-15 20:00:10
-
浙大一院2021年中秋节、国庆节放假及工作安排
2021-09-12 14:00:03
-
什么是阴结?
2021-10-26 10:33:42
-
名医风采 美立方颌面国际专家团,轮廓改造天团
2021-08-23 11:48:32
-
12333异地就医备案 您关心的都在这里
2021-09-07 10:40:49