药企如何开展药物警戒活动
- 2022-02-07 10:20:48
- 产业
□ 张燕芬
新修订《中华人民共和国药品管理法》第十二条第二款指出:“国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制。”这是“药物警戒”术语首次在药品监管领域的最高法规文件中被予以明确。2021年5月,国家药监局发布《药物警戒质量管理规范》(GVP),以规范和指导药品上市许可持有人和药品注册申请人的药物警戒活动,对行业开展药物警戒工作具有重要的指导意义。
国内药企历来侧重于对产品上市前的投入,对于上市后的监测评价往往不够重视,特别是在开展产品全生命周期的安全性监测方面,力量薄弱,存在如内审活动缺乏、程序文件缺失、原始记录缺失、缺乏药学背景的专职人员、不良反应监测相关培训缺失或培训不到位、自主收集不良反应并报告的力度不够、整改不及时或不到位等诸多问题。
笔者认为,在新要求下,药企开展药物警戒活动应重点关注以下方面:
质量管理
药品上市许可持有人(以下简称持有人)需建立与其类型、规模、持有品种的数量及安全性特征等相适应的药物警戒体系,包括机构、人员、制度、资源等方面,并将其关键活动纳入质量保证系统中,包括但不限于组织机构,人员、设备和资源,管理制度,操作规程,有效、畅通的疑似药品不良反应信息收集途径,风险信号识别和评估活动,以及对已识别风险的控制措施。此外,持有人应定期开展内审,或在其药物警戒体系发生重大变化时及时开展内审,以评估其药物警戒体系的适宜性、充分性和有效性。
机构人员与资源
持有人设立的药物警戒部门需要与其他相关部门建立良好的沟通和协调机制,以保障药物警戒活动的顺利开展。在设备与资源方面,应当配备办公区域和设施、网络环境、资料存储空间和设备、文献资源、医学词典、信息化工具或系统等,并进行管理和维护,以使其持续满足需求。
监测与报告
在信息收集方面,持有人可采用电话、传真、电子邮件等多种方式收集来源于自发报告、上市后相关研究及其他有组织的数据收集项目、学术文献、相关网站等涉及的有关信息。
在报告的评价与处置方面,持有人需尽可能全面地收集患者、报告者、怀疑药品以及不良反应发生情况等信息,并做好原始记录,以保证原始记录传递过程中信息的真实、准确、完整、可追溯,并对药品与疑似不良反应之间的关联性进行科学、客观的评价。
在报告提交方面,持有人需按时限提交报告,其中严重的药品不良反应报告不迟于获知信息后的15日,非严重报告不迟于获知信息后的30日,跟踪报告按照个例药品不良反应报告的时限提交。提交报告的内容至少包含可识别的患者、可识别的报告者、所涉药品信息和发生的药品不良反应相关信息。
风险识别与评估
风险识别与评估是持有人开展安全性监测工作一个较为核心的环节。持有人需建立适合本企业及产品特点的信号检测方法,并对以下信号予以重点关注:药品说明书中未提及的药品不良反应;药品说明书中虽有提及但发生频率、严重程度等明显增强的不良反应;疑似新的药品与药品、药品与医疗器械、药品与食品间相互作用导致的药品不良反应;疑似新的特殊人群用药或已知特殊人群用药的变化;疑似不良反应聚集性现象。在风险评估方面,持有人需对信号检测中获取的药品安全风险开展评估,并根据风险评估结果,对已识别风险、潜在风险等采取适当的风险管理措施,主动开展药品上市后安全性研究。
药物警戒计划
药物警戒计划作为药品上市后风险管理计划的一部分,主要用于描述上市后药品安全性特征以及如何管理药品安全风险,主要内容应包含药品安全性概述、药物警戒活动,以及拟采取的风险控制措施、实施时间周期等。
临床试验期间药物警戒
在药物警戒制度实施之前,药品不良反应监测主要侧重于上市后的安全性评估;在新修订药品管理法和GVP等文件颁布实施之后、药品不良反应监测成为一项涵盖上市前和上市后,贯穿产品全生命周期的活动。因此,临床试验期间出现的涉及品种安全性的信息也需要进行监测,以及时发现存在的风险,进而主动采取必要的风险控制措施,确保风险最小化和受试者安全。在时限方面,对于致死或危及生命的可疑且非预期严重不良反应,应当在首次获知后7日内尽快报告,信息完善的随访报告应在首次报告后8日内提交;对于其他可疑且非预期的严重不良反应,应在首次获知后15日内尽快报告。
(作者单位:南京市食品药品监督检验院)
本文地址:http://www.cnzhilian.com/chanye/2022-02-07/570182.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 上一篇:2021年上海生物医药产业规模预计超过7000亿元
- 下一篇:返回列表
- 药企如何开展药物警戒活动2022-02-07 10:20:48
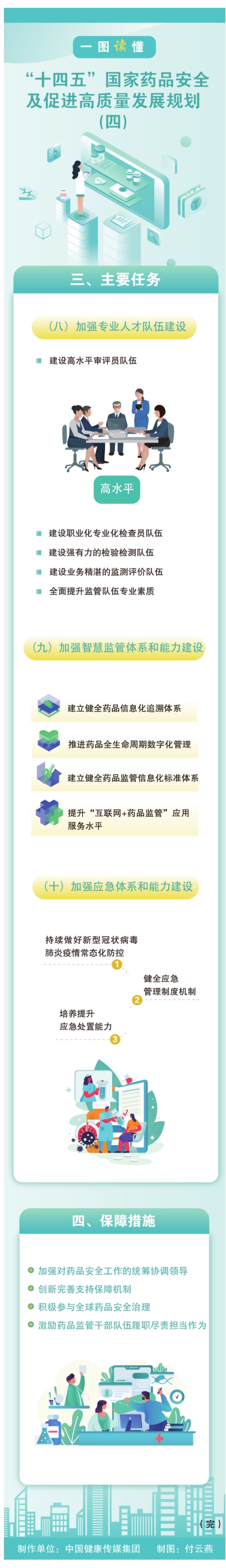
- 【一图读懂】“十四五”国家药品安全及促进高质量发展规划(四)2022-02-07 10:20:18
- 【扬子江质量故事巡礼】吴青青:我与研发有个“约”2022-02-07 10:19:38
- ICH基础知识500问2022-02-07 10:19:16
- 特殊注射剂成创新研发主流方向2022-02-07 10:18:55
-

 什么是阴痛?
什么是阴痛?
2021-10-26
-

 美立方国内外专家齐聚 颌面专家团再升级
美立方国内外专家齐聚 颌面专家团再升级
2021-08-23
-
《热点聚焦》医疗机构内新冠病毒感染防控有了新要求
2021-09-15 20:00:10
-
浙大一院2021年中秋节、国庆节放假及工作安排
2021-09-12 14:00:03
-
什么是阴结?
2021-10-26 10:33:42
-
名医风采 美立方颌面国际专家团,轮廓改造天团
2021-08-23 11:48:32
-
12333异地就医备案 您关心的都在这里
2021-09-07 10:40:49